添加日期:2017年12月28日 阅读:1584
2017年对于药品研发来说是利好频出的,尤其是10月份出台的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》对于完善药品审评审批制度改革以及激励药品创新研发等影响空前。我国的药品研发虽然仍面临重重困难,但改革东风助力,希望能带来更多可喜成果。
2017年已经接近尾声,正在感慨这一年着实过得飞快,有些药企已经不声不响地申报好几种1类新药了,有老牌巨头也有业界黑马。本文重点梳理了2017年(截止到2017.12.20)1类新药的申报情况。
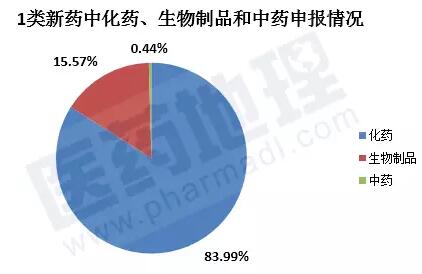
截止到2017.12.20,共申报1类新药456件(以受理号计)。其中化药申请383件,生物制品申请71件,中药申请2件。化药占据近84%。
申请临床vs申请上市
申报临床的为433件,其中LCAR-B38MCAR-T细胞自体回输制剂是我国**受理的CAR-T类药物。申报上市的为23件,其中重组埃博拉病毒病疫苗已获批上市,信迪单抗注射液是**申请上市的国产PD-1单抗。

LCAR-B38MCAR-T细胞自体回输制剂于12月11日被CDE受理临床申请,是南京传奇生物研发的一款靶向B细胞成熟抗原(BCMA)的CAR-T疗法,目前全球已有2款CAR-T类药物上市——诺华的Kymriah和Kite制药的Yescarta,分别在今年8月和10月被FDA批准。
重组埃博拉病毒病疫苗是由军事医学科学院生物工程研究所和康希诺生物股份公司联合研发。埃博拉病毒致死率极高,世界卫生组织将其列为对人类危害*严重的疾病之一,由于疾病本身的严重性和公共卫生方面的需要,该疫苗的审评审批过程可谓“一路开挂”,2015年2月获得临床批件,2017年5月申报上市,2017年6月又以创新药注册申请和重大专项为由,纳入优先审评,2017年10月,被CFDA批准新药注册申请。
信迪单抗是由信达生物制药(苏州)有限公司研发,是继BMS公司Opdivo第二个在中国申请上市的PD-1/PD-L1类药物,用于治疗霍奇金淋巴瘤。目前全球已有5个PD-1/PD-L1类药物上市,国内除信达生物外还有恒瑞、君实、百济神州等企业开展研发布局。
国产申报vs进口申报
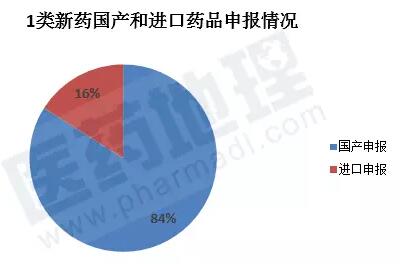
1类新药中国产申报383件和进口申报73件。涉及国内和国外厂家分别为130家和25家。
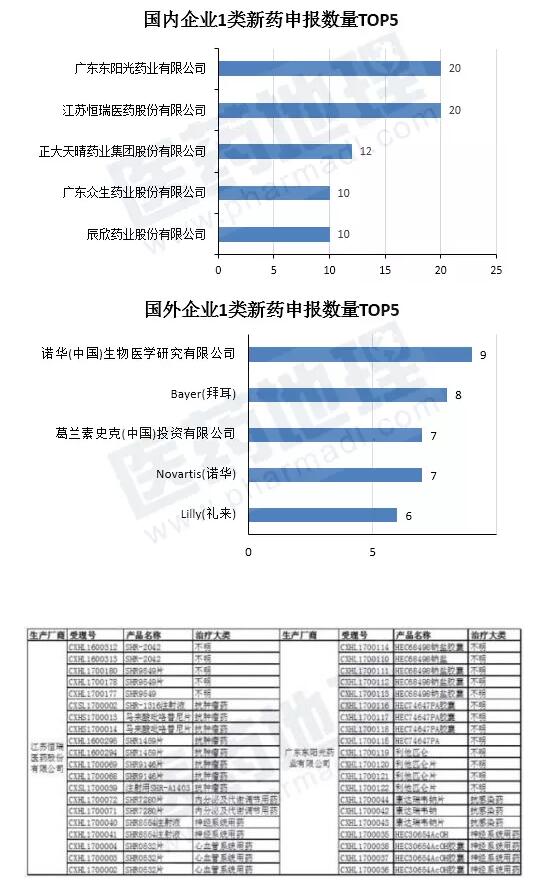
本土企业中,江苏恒瑞医药股份有限公司和广东东阳光药业有限公司两家的申报数量*多,均为20件。国外企业1类新药申报数量*多的5个厂家,均为制药巨头,其中诺华(中国)生物医学研究有限公司申报数量*多,为9件。
恒瑞和东阳光这两家表现不俗的国内企业,恒瑞显然继续发挥抗肿瘤药研发方面的实力,20件1类新药中就有8件为抗肿瘤药,东阳光药业除不明适应症的HEC68498、HEC74647PA以及利他匹仑外,其他两种为抗丙肝药和抗阿尔兹海默症药。
2017年申报的1类新药中,从治疗类别来看,除了无法确认治疗类别的,抗肿瘤药申报数量*多,其次为抗感染药和内分泌及代谢调节用药。抗肿瘤药中靶向小分子药物和单抗类抗肿瘤药表现抢眼,占近半数。
2017年对于药品研发来说是利好频出的,尤其是10月份出台的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》对于完善药品审评审批制度改革以及激励药品创新研发等影响空前。我国的药品研发虽然仍面临重重困难,但改革东风助力,希望能带来更多可喜成果。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号